荧光标记检测技术
原创
2025-05-28 13:49:26
苏州启和医疗科技有限公司
荧光标记检测技术是利用荧光染料或荧光蛋白等标记物与目标分子(如核酸、蛋白质、细胞等)结合,通过检测荧光信号的强度、波长、分布等特性,实现对目标分子的定性、定量或定位分析的技术。
荧光标记检测技术是利用荧光染料或荧光蛋白等标记物与目标分子(如核酸、蛋白质、细胞等)结合,通过检测荧光信号的强度、波长、分布等特性,实现对目标分子的定性、定量或定位分析的技术。其核心优势包括高灵敏度、高特异性、操作简便、可实现多重检测等,广泛应用于生物医学、分子生物学、环境监测、食品安全等领域。以下是该技术的 原理、常用标记物、应用场景及案例 的详细介绍:一、基本原理
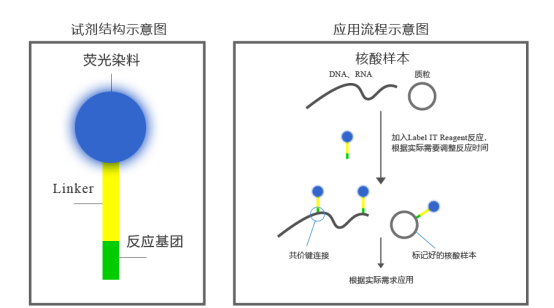
- 荧光标记过程
- 荧光标记物通过化学偶联(如抗体 - 抗原结合、核酸杂交、酶促反应等)与目标分子结合,形成荧光标记复合物。
- 当受到特定波长的激发光照射时,标记物中的荧光基团会吸收能量并跃迁到激发态,随后释放能量回到基态,同时发出特定波长的荧光信号。
- 信号检测
- 通过荧光显微镜、流式细胞仪、荧光分光光度计、酶标仪等设备,检测荧光信号的强度、颜色(波长)、分布或动态变化,从而获取目标分子的信息。
二、常用荧光标记物
| 类型 | 常见标记物 | 特点 | 应用场景 |
|---|
| 荧光染料 | 荧光素(FITC)、罗丹明(Rhodamine) | 小分子,易与生物分子偶联,激发 / 发射波长覆盖可见光范围,成本较低。 | 免疫荧光染色、核酸染色 |
| 近红外荧光染料 | 吲哚菁绿(ICG)、Cy5、Cy7 | 波长较长(700-1000 nm),组织穿透性强,背景荧光干扰少。 | 活体成像、肿瘤手术导航 |
| 荧光蛋白 | 绿色荧光蛋白(GFP)、mCherry、mNeonGreen | 基因编码,可通过转染在细胞或生物体中表达,适用于实时动态追踪。 | 细胞标记、转基因生物研究 |
| 量子点 | CdSe/ZnS 量子点 | 荧光强度高、稳定性强、激发光谱宽,可通过调节尺寸实现多色标记。 | 多重荧光成像、生物传感器 |
| 纳米颗粒 | 荧光微球、上转换纳米颗粒 | 可负载多个荧光分子,信号放大能力强,适用于超灵敏检测。 | 免疫层析试纸、核酸检测 |
三、典型应用场景及案例
1. 生物医学与分子生物学
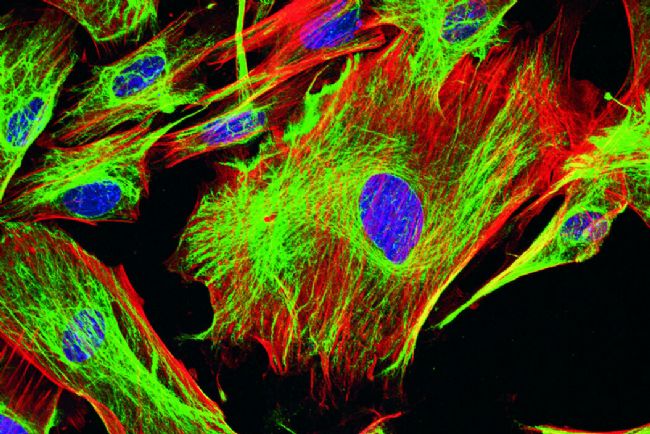
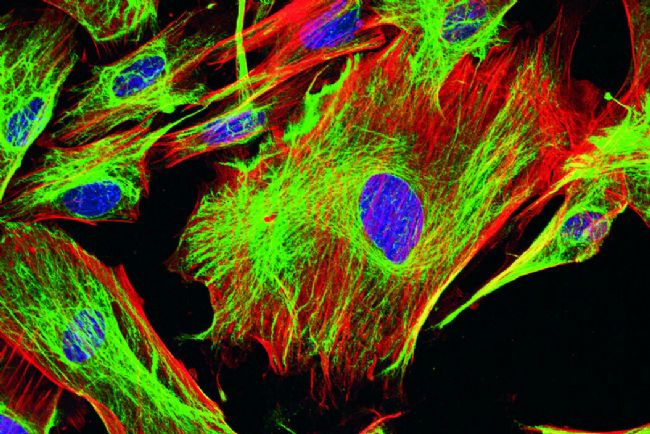
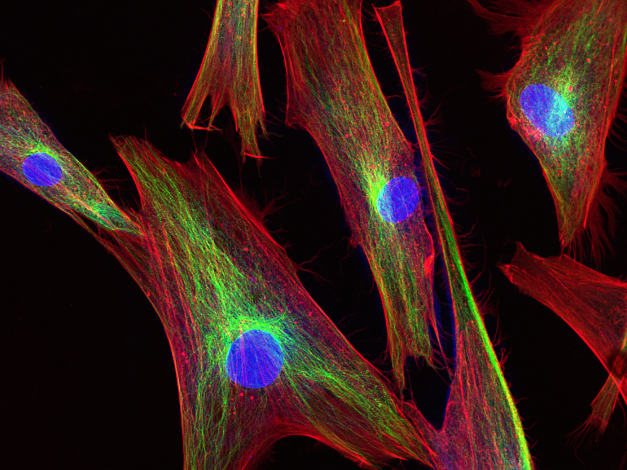
- 免疫荧光染色(IF)
- 原理:利用荧光标记的抗体特异性结合细胞或组织中的抗原,通过荧光显微镜观察抗原的分布和表达水平。
- 案例:在肿瘤病理诊断中,通过荧光标记的抗体(如细胞角蛋白、Ki-67 等)对组织切片染色,可快速鉴别肿瘤细胞类型及增殖活性,辅助癌症分型和治疗方案制定。
- 荧光原位杂交(FISH)
- 原理:用荧光标记的核酸探针与细胞或染色体上的目标 DNA/RNA 杂交,检测基因拷贝数变异、染色体易位等。
- 案例:慢性粒细胞白血病(CML)的诊断中,通过 FISH 技术检测 BCR-ABL 融合基因(荧光标记的探针分别标记 BCR 和 ABL 基因,融合时显示荧光信号重叠),确诊率可达 95% 以上。
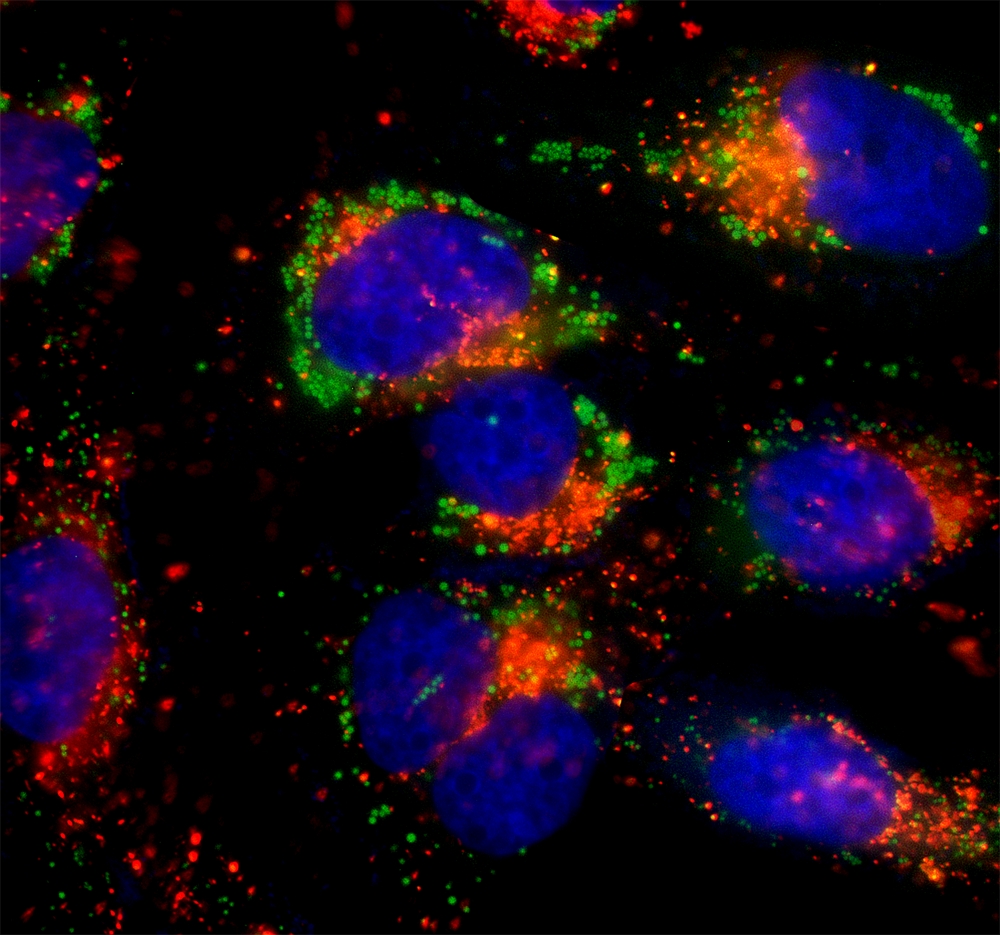
- 流式细胞术(FCM)
- 原理:用荧光标记的抗体标记细胞表面抗原,通过流式细胞仪对单细胞进行高通量检测,分析细胞亚群比例、活性或功能状态。
- 案例:艾滋病(HIV)患者的病情监测中,通过荧光标记的 CD4 + 和 CD8 + 抗体检测 T 细胞亚群计数,评估免疫系统损伤程度。
2. 疾病诊断与治疗
- 荧光分子 tomography(FMT)
- 原理:利用近红外荧光染料标记肿瘤特异性分子(如靶向表皮生长因子受体 EGFR 的探针),通过断层成像技术实现深部肿瘤的无创检测。
- 案例:美国 FDA 批准的吲哚菁绿(ICG)用于肝癌手术中,通过近红外荧光成像实时显示肿瘤边界,辅助医生精准切除肿瘤组织,减少正常组织损伤。
- 荧光引导手术(FGS)
- 原理:术前或术中注射荧光标记的示踪剂(如 ICG 标记的单克隆抗体),肿瘤组织因特异性摄取示踪剂而发出荧光,通过荧光腹腔镜或显微镜实时导航手术。
- 案例:在乳腺癌手术中,用荧光标记的前哨淋巴结示踪剂(如 ICG - 纳米胶体)定位前哨淋巴结,提高淋巴结活检的准确性,避免过度切除造成的并发症。
3. 环境与食品安全检测
- 水中污染物检测
- 原理:利用荧光染料与污染物(如重金属离子、有机污染物)结合后荧光信号的变化(增强或淬灭),实现快速定量检测。
- 案例:中国科学院开发的荧光探针 CDots(碳量子点)可特异性识别 Hg²+ 离子,检测限低至纳摩尔级别,用于饮用水中汞污染的现场快速筛查。
- 食品微生物检测
- 原理:用荧光标记的核酸适配体或抗体靶向结合细菌(如大肠杆菌、沙门氏菌),通过荧光显微镜或流式细胞仪计数。
- 案例:日本开发的荧光微球免疫层析试纸,可在 30 分钟内检测食品中的李斯特菌,灵敏度比传统培养法提高 100 倍。
4. 细胞与发育生物学研究
- 荧光蛋白标记的转基因动物
- 原理:通过基因编辑技术(如 CRISPR-Cas9)将荧光蛋白基因(如 GFP、mCherry)插入目标基因位点,使特定细胞或组织表达荧光蛋白,用于追踪细胞命运或器官发育过程。
- 案例:斑马鱼胚胎发育研究中,用 GFP 标记血管内皮细胞,通过活体荧光成像实时观察血管生成的动态过程,为血管疾病机制研究提供模型。
- 荧光共振能量转移(FRET)
- 原理:当两个荧光分子(供体和受体)距离小于 10 nm 时,供体的荧光能量可转移至受体,导致供体荧光减弱或受体荧光增强,用于检测分子间相互作用(如蛋白质 - 蛋白质结合)。
- 案例:研究 G 蛋白偶联受体(GPCR)的激活机制时,用 FRET 技术标记受体和下游信号分子,实时监测受体激活后信号传导的动态变化。
四、技术优势与挑战
- 优势
- 高灵敏度:检测限可达皮摩尔(pM)甚至飞摩尔(fM)级别,适用于微量样本分析。
- 高特异性:通过抗体、核酸探针等靶向识别,可区分结构相似的分子(如同分异构体)。
- 多功能性:可实现定性、定量、定位及动态追踪,支持单细胞分析和活体成像。
- 挑战
- 背景干扰:生物样本中的自发荧光(如胶原蛋白、脂质)可能影响检测信噪比。
- 标记效率:标记过程可能影响目标分子的生物学活性(如酶活性、抗体亲和力)。
- 组织穿透限制:可见光波长的荧光染料在生物组织中穿透深度有限(通常 < 1 mm),近红外染料可改善但仍有局限。
五、未来发展方向
- 多色荧光成像与空间组学:结合多重荧光标记和高分辨率成像技术(如超分辨显微镜),实现单个细胞内多种分子的定位和互作分析。
- 智能响应型荧光探针:开发对 pH、温度、酶活性等微环境敏感的荧光探针,用于实时监测病理状态下的细胞微环境变化。
- 人工智能(AI)与荧光检测结合:利用 AI 算法自动分析荧光图像中的复杂模式,提高诊断效率和准确性(如癌症病理图像的自动化判读)。
荧光标记检测技术正朝着 高分辨率、高通量、智能化 的方向发展,未来将在精准医学、新药研发、环境监测等领域发挥更重要的作用。








请先 登录后发表评论 ~